肝癌
肝癌是什麼?
原發性肝癌是一種惡性(癌症)細胞在肝臟組織中形成的疾病。若是在身體其他部位形成並轉移到肝臟的癌症則並非為原發性肝癌。肝臟是人體最大的器官之一,位於腹部右上方、肋骨內側,分為左右兩葉。肝臟的主要功能,包括以下:
- 製造膽汁並能幫助消化食物中的脂肪
- 儲存肝醣(糖分),供身體作為能量來源
- 過濾血液中的有害物質,並經由糞便和尿液排出體外
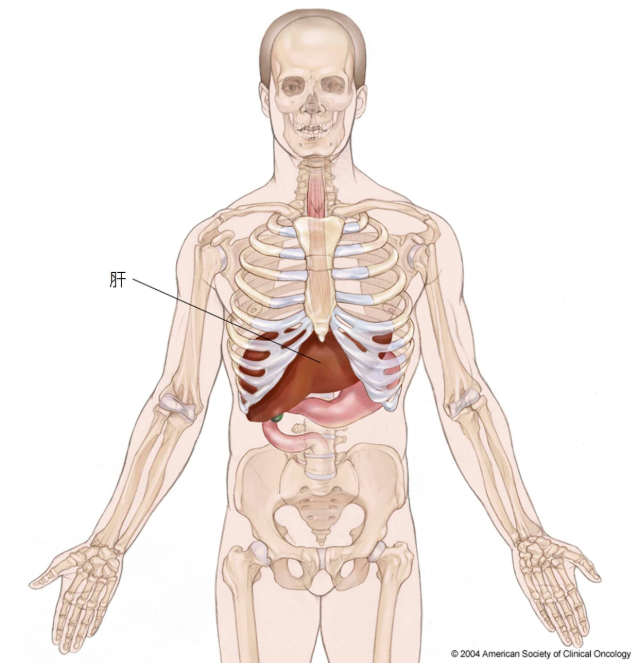
(圖片來源:癌症圖說 肝臟位於上腹部,鄰近胃、小腸、膽囊與胰臟。肝臟分為右葉與左葉。)
肝癌的種類
成人原發性肝癌的主要類型是肝細胞癌與膽管癌(膽道癌)。
最常見的成人原發性肝癌是肝細胞癌,而肝癌更是全球癌症死亡排名的第三位。
原發性肝癌可能發生於成人與兒童,而兒童的肝癌治療方式與成人不同。
在全球範圍內,肝癌是第六常見的癌症,亦是第三大癌症死亡原因。
在美國,肝癌發生率在美洲原住民或阿拉斯加原住民中最高,肝癌是美國第六大癌症死亡原因。
在台灣,根據民國111年(西元2022年)衛生福利部癌症登記報告指出,當年肝癌發生率的排名第4位(於男性為第4位、女性為第6位);民國112年死亡率的排名第2位(於男性為第2位、女性為第4位)。死亡率相對較高,但近年來有下降趨勢。與全國施行新生兒全面施打B型肝炎疫苗政策之後及慢性B肝和C肝肝炎及早治療、長期控制是關鍵相關,施打B型肝炎疫苗政策已經有效降低肝癌發生率達75%。
資料來源:衛生福利部國民健康署
肝癌的徵兆與症狀
以下這些及其他徵兆與症狀可能由成人原發性肝癌或其他疾病引起的。如果您出現以下任何一種的症狀,請與您的醫師確認:
- 右側肋骨下方出現硬塊
- 右側上腹部不適
- 腹部腫脹
- 右肩胛骨附近或背部疼痛
- 黃疸(皮膚與眼白發黃)
- 容易瘀青或出血
- 異常疲倦或虛弱
- 噁心與嘔吐
- 食慾不振或少量進食後即感到飽足
- 不明原因的體重減輕
- 糞便顏色變淡甚是呈灰白色便、尿液呈深色
- 發燒
本文出處:“What Is Liver Cancer? was originally published by the National Cancer Institute.”
Available at: “What Is Liver Cancer? was originally published by the National Cancer Institute.”
新北市立土城醫院血液腫瘤科顧問級主治醫師 廖宗琦 協助校閱
更新日期:2025.08.10
肝癌的成因與危險因子
成人中最常見的肝癌類型是肝細胞癌(HCC),通常發生於肝炎病毒感染或肝硬化引起的慢性(長期)肝病患者。男性比女性更容易罹患肝細胞癌。有多種危險因子的人,其罹患肝癌的危險更高。
許多危險因子會與肝癌有關,但並非所有擁有一種或多種危險因子的人都會罹患肝癌,即使沒有任何已知危險因子的人仍可能罹患肝癌。危險因子包括下列:
- B型肝炎病毒(HBV)感染:B型肝炎病毒可經由血液、精液或其他體液傳播。感染可在分娩時由母親傳給嬰兒,或透過性接觸或共用注射毒品的針具傳播。這種感染會導致肝臟發炎(腫脹),進而引發癌症。嬰兒期定期接種HBV疫苗有助於降低B型肝炎病毒的發生率,慢性B型肝炎病毒感染是亞洲與非洲罹患肝癌的主要原因。
- C型肝炎病毒(HCV)感染:C型肝炎病毒是經由血液感染。這種感染可透過共用注射毒品針頭,或透過性接觸傳染(這種情況比較少見)。過去,C型肝炎病毒也可能透過輸血或器官移植傳播,如今,所有捐血都會做HCV檢測,因此輸血傳染風險已大大降低。C型肝炎病毒會引起肝硬化,進而可能導致肝癌。慢性C型肝炎病毒感染是北美、歐洲與日本罹患肝癌的主要原因。
- 肝硬化:肝硬化的人會增加罹患肝癌的風險。肝硬化是一種肝臟疾病,即健康肝組織被疤痕組織取代。疤痕組織會阻塞肝臟的血液流動,導致其功能受損。慢性酒精中毒與慢性肝炎是肝硬化常見原因。由C型肝炎病毒導致的肝硬化者,罹患肝癌的風險高於由B型肝炎病毒或酒精引起的肝硬化者。
- 重度飲酒:重度飲酒導致肝硬化,進而提高罹患肝癌的風險。即使沒有肝硬化,重度飲酒者也可能罹患肝癌。若重度飲酒者已有肝硬化,其罹癌風險是沒有肝硬化的重度飲酒者的十倍。
研究顯示,B型肝炎病毒或C型肝炎病毒感染者若同時也是重度飲酒者,則罹患肝癌風險也會增加。 - 黃麴毒素B1(Aflatoxin B1):食用含有黃麴毒素B1(由真菌產生、常見於儲存在高溫潮濕環境中的玉米與堅果)的食物,可能增加罹患肝癌的風險。此問題最常見於撒哈拉以南的非洲、東南亞與中國。
- 非酒精性脂肪性肝病(NASH):NASH是一種可能導致肝硬化,進而引發肝癌的疾病。它是非酒精性脂肪肝病中最嚴重的一種,肝臟中脂肪含量異常,在這些人中,會導致肝發炎與細胞受損。
若有NASH相關肝硬化,會增加罹患肝癌風險,即使沒有肝硬化的NASH患者中,也可能發現肝癌的案例。 - 吸菸:吸菸與肝癌風險增加有關,風險會隨著每日吸菸數量與吸菸年數的增加,罹患癌症的風險也增加。
- 其他疾病:某些罕見醫學與遺傳疾病也會增加罹患的肝癌風險,包括:
- 未治療的遺傳性血鐵沉積症(hereditary hemochromatosis)
- α1-抗胰蛋白酶缺乏症(alpha-1 antitrypsin deficiency)
- 肝醣儲積症(glycogen storage disease)
- 晚發性皮膚紫質症(porphyria cutanea tarda)
- 威爾森氏症(Wilson disease)
本文出處:“Liver Cancer Causes, Risk Factors, and Prevention was originally published by the National Cancer Institute.”
Available at: https://www.cancer.gov/types/liver/what-is-liver-cancer/causes-risk-factors
新北市立土城醫院血液腫瘤科顧問級主治醫師 廖宗琦 協助校閱
更新日期:2025.08.10
診斷肝癌
如何診斷肝癌
透過檢查肝臟和血液的檢查可用來測出和診斷肝癌,並非所有人都會接受下列所述的所有檢查。
可能使用以下的檢查與程序:
- 理學檢查與病史:理學檢查在確認個人的健康表徵,包括尋找疾病之徵兆,例如腫塊或其他異常情況,以及病人的健康習慣、過往疾病與治療史。
- 甲型胎兒蛋白(AFP)腫瘤標記檢查: 腫瘤標記是由身體的器官、組織或腫瘤細胞釋放到血液中的物質。血液中AFP的濃度升高可能是肝癌的徵兆。
- 其他癌症和某些非癌性疾病,包括肝硬化與肝炎,也可能導致AFP濃度升高。
- 有時即使罹患肝癌,AFP濃度也可能是正常的。
- 肝功能檢查: 這些血液檢查可測量肝臟釋放到血液中的某些物質的濃度。若某種物質的濃度高於正常數值,可能是肝癌的徵兆。
- 電腦斷層掃描(CT掃描或CAT掃描): 將X光機連接到電腦拍攝體內,如腹部,從不同角度拍攝體內一系列的詳細影像。可能會注射或口服顯影劑,幫助器官或組織顯現得更清楚。這項檢查也稱為「電腦斷層攝影」。
- 顯影劑注射後可能會在三個不同時間點拍攝影像,以獲得肝臟異常區域的最佳影像,這稱為三期CT掃描(triple-phase CT)。
- 螺旋式CT掃描使用X光機以螺旋方式掃描身體,產生一系列非常詳細的體內影像。
- 磁振造影(MRI): 這項檢查使用磁力、無線電波與電腦,拍攝身體內部區域,如肝臟的詳細影像。
- 為了拍攝肝臟內與附近血管的清晰影像,會使用顯影劑注射到靜脈中。此程序稱為磁振血管攝影(magnetic resonance angiography)。
- 顯影劑注入後,也會在三個時間點進行拍攝,以獲得肝臟異常區域的最佳影像,這稱為三期MRI。
- 超音波檢查: 這項檢查使用高能量聲波(超音波)照射肝臟並產生迴聲。這些迴聲會形成肝臟的影像,稱為超音波影像。
- 切片檢查: 進行切片檢查時,會取出細胞或組織檢體,經由病理學家在顯微鏡下觀察是否有癌症跡象。取樣的方法包括:
- 細針穿刺切片(Fine-needle aspiration biopsy): 使用細針抽取液體、組織或細胞檢體。
- 粗針切片(Core needle biopsy): 使用稍粗的針抽取細胞或組織樣本。
- 腹腔鏡檢查(Laparoscopy): 這是一種外科手術,用於檢查腹部內的器官是否有疾病跡象。手術會在腹壁上開幾個小切口,將一根細長帶有光源的腹腔鏡插入其中一個切口,其他器械也可透過同一切口或其他切口插入,以取出組織檢體。
診斷肝癌不是一定需要做切片,有時醫師會根據影像檢查,如CT與MR的結果來診斷肝癌。
確診為原發性肝癌後,需要進行其他檢查,以確認癌細胞是否已擴散在肝內或身體其他部位。確認癌症大小、位置,以及是否擴散的,因此需要得知腫瘤的擴展程度,叫做分期。
一些用來診斷肝癌的檢查,如CT與MRI也可用於判定分期。此外,還可能會進行正子斷層掃描(PET掃描):
- 正子斷層掃描(PET掃描): 這項檢查用來偵測體內的惡性腫瘤細胞。會將少量放射性葡萄糖(糖)注射到靜脈。PET掃描儀會繞著身體旋轉並拍攝體內哪些部位正在使用葡萄糖的影像。惡性腫瘤細胞在影像中會顯示的更亮,因他們比正常細胞更活躍,吸收更多葡萄糖。
哪些因素會影響肝癌的預後?
當診斷出肝癌,預後(康復的機率)與治療選擇將取決於以下因素:
- 癌症的期別(腫瘤的大小、是否影響部分或全部肝臟、是否已擴散到身體其他部位)
- 肝臟功能的狀況
- 病人整體身體狀況,包括是否有肝硬化
早期發現與治療肝癌,可能可以預防因肝癌而導致的死亡。
本文出處:“Liver Cancer Diagnosis was originally published by the National Cancer Institute.”
Available at: https://www.cancer.gov/types/liver/what-is-liver-cancer/diagnosis
新北市立土城醫院血液腫瘤科顧問級主治醫師 廖宗琦 協助校閱
更新日期:2025.08.10
肝癌分期
本文內容為成人肝癌的分期。分期是描述癌症在體內的擴散程度,了解肝癌的分期有助於醫師規劃最佳的治療方案。
如您想了解用於診斷與分期原發性肝癌的檢查與步驟,請參見前面《肝癌診斷》單元閱讀。
肝癌有數種的分期系統,「巴塞隆納臨床肝癌分期系統(Barcelona Clinic Liver Cancer, BCLC)」是廣泛用於原發性肝癌的分期系統。該系統根據以下因素預測病人的預後並制定治療方案:
- 癌症是否已擴散至肝臟內或身體其他部位
- 肝臟功能的狀況
- 病人的整體身體狀況
- 癌症引起的症狀
BCLC分期系統分五個期別:
- 第0期:極早期
- 第A期:早期
- 第B期:中期
- 第C期:晚期
- 第D期:末期
針對成人肝癌,分期也可根據癌症的治療方式分為以下:
- 局部性肝癌:癌細胞尚未擴散到肝臟以外,可經由手術切除。此類包括BCLC第0、A與B期。
- 局部晚期肝癌:癌細胞尚未從肝臟擴散至身體其他部位,但無法安全以手術切除腫瘤。此類包括BCLC第C期。
轉移性肝癌:
癌症已從肝臟擴散至身體其他遠端部位,無法以手術完全切除腫瘤。此類包括BCLC第D期。
肝外轉移:
最常見的侵犯對象是肺臟,其餘為骨頭、腹腔、淋巴結、腦部等,依轉移的部位而有不同症狀,例如轉移到肺臟時,可能出現咳嗽、喘;轉移到骨頭,大多會疼痛;轉移到淋巴結而壓迫到神經時,會引起疼痛;轉移到腦部則視病灶位置,可能出現頭痛、出血、甚至神智不清等症狀。
肝腫瘤破裂
肝腫瘤破裂是一種緊急情況,可能導致大量出血,危及生命。
肝腫瘤破裂後,但急性期的死亡率可達25%至75%。
即使接受傳統手術切除,肝腫瘤破裂病人的存活率也顯著低於非破裂病人。
自發性緩解(Spontaneous Remission)
指在沒有接受任何明確治療的情況下,疾病的症狀或病灶自然消失或明顯改善的現象。可能發生但原因不詳:
- 肝癌復發指得是癌症在治療後再次回來,癌症可能復發在肝臟或身體其他的部位。如需更多資訊,請前往網站《癌症的復發:當癌症再回來時》單元閱讀。
本文出處:“Liver Cancer Stages was originally published by the National Cancer Institute.”
Available at: https://www.cancer.gov/types/liver/what-is-liver-cancer/stages
新北市立土城醫院血液腫瘤科顧問級主治醫師 廖宗琦 協助校閱
更新日期:2025.08.10
治療肝癌
肝癌有不同的治療方式。有些是標準治療(目前使用的治療方法),有些則正在臨床試驗中測試。
治療類型
ㄧ、監測
監測用於篩檢中發現小於1公分的病灶,通常每3個月進行一次的追蹤。監測是指密切觀察病人的病情,在檢查結果未顯示惡化前不給予任何治療。積極監測期間,會定期進行檢查與檢測。
二、手術
可進行部分肝切除手術(切除肝臟中發現的癌症部分),可能切除一塊組織、整個肝葉,或更大部分的肝臟,連同周圍的部分健康組織。剩餘的肝臟組織會承接肝功能,並肝臟可能再生長。
三、肝臟移植
肝臟移植是指切除整個肝臟,並用捐贈的健康肝臟取代。若癌症僅侷限於肝臟且可找到捐贈肝臟時,則可進行移植。如果這個人需要等待捐贈肝臟,則可視需要在此期間進行其他治療。
四、燒灼治療
燒灼治療用於切除或破壞組織。肝癌病人可使用以下不同類型的燒灼治療:
- 無線射頻燒灼術(Radiofrequency ablation):利用特殊針頭經由皮膚或腹部切口插入到腫瘤部位,再運用高能量電波加熱針頭和腫瘤,以殺死癌細胞。
- 微波治療(Microwave therapy):腫瘤暴露微波產生的高溫下,這可破壞並殺死癌細胞,或使其對放療與抗癌藥物反應更敏感。
- 經皮酒精注射治療(Percutaneous ethanol injection):使用細針將乙醇(純酒精)直接注射至腫瘤中以殺死癌細胞。可能需數次治療,通常使用局部麻醉,但若肝內腫瘤較多,則可能使用全身麻醉。
- 冷凍消融術(Cryoablation):使用儀器冷凍並摧毀癌細胞,這種治療也稱冷凍治療或冷凍手術。醫師可能會使用超音波引導儀器。延伸閱讀《治療癌症的冷凍手術》。
- 電穿孔療法(Electroporation therapy):透過放置在腫瘤內的電極,傳送電脈衝以殺死癌細胞。電穿孔療法目前仍正在臨床試驗中研究。
五、栓塞治療
栓塞治療適用於無法手術切除腫瘤或接受燒灼治療,且腫瘤尚未擴散至肝外的人。栓塞治療是使用物質阻斷或減少肝動脈通往腫瘤的血流,當腫瘤無法獲得足夠氧分與養分,它就無法持續生長。
肝臟的血液是從肝門靜脈與肝動脈來的。從肝門靜脈進入肝臟的血液通常會流向健康的肝組織,而肝動脈的血液通常會流向腫瘤。進行栓塞治療時是阻斷肝動脈,健康的肝組織仍可從肝門靜脈獲得血液。
栓塞治療主要有兩種:
- 經動脈栓塞術(Transarterial embolization, TAE):在大腿內側開小切口,插入一根導管(細而柔軟的管子)並引導至肝動脈。當導管到位後,注射一種可阻斷肝動脈並阻止血液流向腫瘤的物質。
- 經動脈導管化學栓塞術(Transarterial chemoembolization, TACE):與TAE類似,但會給予抗癌藥物。抗癌藥物可附著在微粒小球中注入肝動脈,或將抗癌藥物透過導管注入肝動脈後再注入射栓塞物質。多數抗癌藥物會集中在腫瘤附近,僅少量進入其他身體部位,這類治療也稱化療栓塞術。
六、標靶治療
標靶治療是使用藥物或其他物質識別並攻擊特定癌細胞的治療方法。用於治療晚期肝癌的標靶藥物包括:
- Bevacizumab (商品名:Avastin癌思停)
- Cabozantinib (商品名:Cabometyxu癌必定)
- Lenvatinib (商品名:Lenvima樂衛瑪)
- Ramucirumab (商品名:Cyramza欣銳擇)
- Regorafenib (商品名:Stivarga癌瑞格)
- Sorafenib (商品名:Nexavar蕾莎瓦)
延伸閱讀,《癌症的標靶治療》與副作用。
七、免疫治療
免疫治療是利用人體的免疫系統對抗癌症的一種治療。利用人體本身或實驗室製造的物質來增強、引導或恢復人體對抗癌症的自然防禦能力。
免疫檢查點抑制劑是一種免疫治療,可用於治療肝癌的免疫檢查點抑制劑,包括:
- atezolizumab 搭配標靶藥物bevacizumab或cabozantinib
- durvalumab 搭配 tremelimumab
- nivolumab 搭配 ipilimumab
- pembrolizumab
八、放射治療
體外放射線治療利用體外機器發射高能量X光或其他類性的放射線照射癌症部位。因為放射治療是一系列治療會分次給予,以便使健康細胞恢復並提高放射治療效果。治療次數取決於腫瘤大小與位置,某些體外放射治療有助於防止放射線傷害附近的健康組織。
特殊放療方式可減少對鄰近健康組織的損傷,包括:
- 順形放射治療(Conformal radiation therapy):它是使用電腦產生腫瘤的3D影像,並調整放射束的角度對準腫瘤形狀進行照射。這使得高劑量的放射線能到達腫瘤,並減少對附近正常組織的傷害。
- 全身立體定位放射治療(Stereotactic body radiation therapy):它是使用特殊設備讓病人在每次治療時維持相同姿勢,持續數天,每日一次,放射機器準確對準腫瘤給予高劑量照射。透過讓病人在每次治療中都保持同一位置,可以減少對附近組織的損傷,這種程序也稱為立體定位放射治療(SBRT)及立體定位放射治療(SRT)。
- 質子束放射治療(Proton beam radiation therapy):這種治療是一種高能量的體外放射治療,利用質子流(帶正電的微小粒子)殺死腫瘤細胞。這種治療可減少對腫瘤附近健康組織的輻射傷害。
延伸閱讀,請前往網站《放射治療癌症》與《放射治療副作用》單元。
九、臨床試驗
對於某些病人來說,參加臨床試驗可能是一種治療的選擇。針對癌症病人,有多種不同類型的臨床試驗。例如測試新治療或改善現有治療的試驗,以及為了改善癌症病人生活品質的支持性照護試驗與緩和照護試驗,它們是特別針對改善癌症與其治療產生的副作用的試驗。
您可以詢問您的主治醫師是否有適合您的臨床試驗,或者您想了解目前正在進行中的臨床試驗有哪些,您可以前往「台灣臨床試驗資訊平台」、各醫院臨床試驗中心網站與ClinicalTrials.gov查詢。
延伸閱讀,請前往網站《 認識試驗資訊 》單元,閱讀更多關於臨床試驗相關資訊。
本文出處:“Liver Cancer Treatment was originally published by the National Cancer Institute.”
https://www.cancer.gov/types/liver/what-is-liver-cancer/treatment
新北市立土城醫院血液腫瘤科顧問級主治醫師 廖宗琦 協助校閱
更新日期:2025.08.10
局部性肝癌的治療選擇
局部性肝癌,其治療可能包括:
- 小於1公分病灶時,使用監測
- 部分肝切除術(手術切除肝臟中發現癌症的區域)
- 肝臟移植
- 腫瘤燒灼術,包括:
- 無線射頻燒灼術
- 微波治療
- 經皮酒精注射術
- 冷凍消融術
- 放射治療
局部晚期或轉移性肝癌的治療
局部晚期或轉移性肝炎,其治療可能包括:患者還必須符合以下條件其中之一:
- 有肝外轉移(遠端轉移或肝外淋巴結侵犯)。
- 大血管侵犯(腫瘤侵犯門靜脈主幹或侵犯左/右門靜脈第一或第二分支)。
- 經導管動脈化學藥物栓塞(TACE)治療失敗者,需提供患者於12個月內大於等於3次局部治療的紀錄。
免疫合併標靶藥物治療
這是目前晚期肝癌一線治療的首選方案,例如,使用 atezolizumab + bevacizumab 或 cabozantinib,durvalumab + tremelimumab,nivolumab + ipilimumab,或 pembrolizumab 藥物組合是晚期肝細胞癌(以下簡稱肝癌)的第一線療法,也是目前最強效的藥物,有5%的人肝腫瘤有機會消失。
肝癌免疫治療的優勢,延長存活期
- 免疫治療可以顯著延長晚期肝癌患者的存活期,特別是與傳統標靶藥物相比。
- 提高生活品質:免疫治療的副作用相對較小,可以改善病人的生活品質。
- 有機會將晚期肝癌降階:某些晚期肝癌病人在接受免疫治療後,腫瘤縮小,甚至可以接受手術治療。
免疫加標靶肝癌免疫治療的注意事項
- 副作用:免疫治療可能出現免疫介導性不良反應(irAEs),如皮膚、腸胃等問題,需要由醫師監控和處理。
- 經濟負擔:部分免疫藥物需要自費,經濟負擔較重。
- 並非所有人都有效:免疫治療的效果因人而異,需要由醫師評估。
早期診斷和治療
肝癌早期診斷和治療仍然非常重要,早期治療可以提高治癒率。
肝癌的復發治療
原發性肝癌復發,其治療選擇可能包括:
- 全肝切除(手術切除全部肝臟)與肝臟移植
- 部分肝切除術(手術切除肝臟中腫瘤的部位)
- 燒灼療法
- 放射線治療
- 經動脈導管化學栓塞術(TACE)與 sorafenib 作為緩和療法,用以緩解症狀並改善生活品質
本文出處:“Liver Cancer Treatment was originally published by the National Cancer Institute.”
https://www.cancer.gov/types/liver/what-is-liver-cancer/treatment
新北市立土城醫院血液腫瘤科顧問級主治醫師 廖宗琦 協助校閱
更新日期:2025.08.10
預防肝癌
預防癌症是採取行動以降低罹癌的機率。透過預防癌症,可以降低某群體或人群中新發癌症病例數,進而希望降低癌症的死亡率。
任何會增加罹癌風險的因素稱為危險因子,任何能降低罹癌風險的因素稱為保護因子。預防措施包括避免危險因子與增加保護因子。
以下是肝癌的保護因子:
- 接種B型肝炎疫苗:在新生兒期接種HBV疫苗已被證實可以降低兒童罹患肝癌的風險。C型肝炎無疫苗,目前尚不清楚是否能降低成人的罹癌肝癌的風險。
- 治療慢性B型肝炎:慢性HBV感染者的治療選項包括干擾素與核苷酸類似物療法。這些治療可能有助於降低罹患肝癌的風險。
- 減少接觸黃麴毒素B1:以含有較低黃麴毒素B1的食物取代高含有大量黃麴毒素B1食物,可以降低罹患肝癌的風險。
本文出處:“Liver Cancer Causes, Risk Factors, and Prevention was originally published by the National Cancer Institute.”
https://www.cancer.gov/types/liver/what-is-liver-cancer/causes-risk-factors
新北市立土城醫院血液腫瘤科顧問級主治醫師 廖宗琦 協助校閱
更新日期:2025.08.10
更新日期:2025/08/10


