細胞治療
CAR-T 細胞:改造病人的免疫細胞來治療癌症
數十年以來,癌症治療的基礎是以手術、化學治療和放射治療為主,至今這些仍是治療的重要方法,但近期新的治療種類改變了癌症病人的治療風貌。
21世紀指向性的標靶治療出現,如imatinib(Gleevec基利克)和trastuzumab(Herceptin賀癌平)等藥物,它們能辨識癌細胞中的特定分子變化進而達到殺死癌細胞。數十種標靶治療現在已經是許多癌症的標準治療選項。
而在過去十年中,「免疫治療」—此治療是利用增強病人免疫系統的能力去攻擊腫瘤--已經迅速成為許多人所說癌症治療的"新典範經典"。這是因為增強免疫系統的藥物已經顯示出有能力縮小,甚至根除某些晚期癌症病人的腫瘤,而在一小部分的病人中,這種治療反應可持續數年。
例如,被稱為「免疫檢查點抑制劑」的藥物,已經被廣泛用於治療許多類型的癌症病人,包括黑色素瘤、肺癌、腎臟癌、膀胱癌和淋巴瘤。
但另一種稱之為「嵌合抗原接受體T細胞 (CAR-T細胞) 」療法的免疫治療,也同樣引起研究人員和腫瘤學專家極大的興趣。雖然CAR-T細胞療法並沒有像免疫檢查點抑制劑那樣被廣泛使用,但它們已經顯示出同樣的能力,可以根除非常晚期的淋巴球性白血病和淋巴瘤,並能抑制癌症許多年。
自2017年以來,已有六種CAR-T細胞療法被美國食品藥物管理署(FDA)核准。這些核准用於治療血液癌症,包括淋巴瘤、某些形態的白血病,以及最近核准的多發性骨髓瘤。
儘管這些療法的成果是令人振奮,但接受治療的病人長期存活率不到一半。它們的費用也引起了些許的經濟壓力疑慮,就最近核准的CAR-T細胞療法而言,其單次費用就超過45萬美元(約折合新台幣1200萬)。
然而,經過多年的辛苦研究,CAR-T細胞療法已經進入了癌症治療的主流,美國NCI癌症研究中心外科主任、免疫治療和CAR-T細胞療法的先驅者、Steven Rosenberg教授如此說道。
Rosenberg教授說"[CAR-T細胞]目前在美國和其他國家已逐漸被使用,並已成為侵襲性(高惡性度)淋巴瘤病人的標準治療選項之一,","它們已經成為現代醫學的一部分"。
| 學名 | 商品名 | 標靶抗原 | 目標疾病 | 病人族群 |
|---|---|---|---|---|
| Tisagenlecleucel | Kymriah | CD19 | B細胞急性淋巴性白血病 (ALL) | 適用於治療兒童和年輕成人的復發或難治型的B細胞急性淋巴性白血病 |
| B細胞非何杰金氏淋巴瘤 (NHL) | 適用於治療成人復發或難治型的B細胞非何杰金氏淋巴瘤 | |||
| Axicabtagene ciloleucel | Yescarta | CD19 | B細胞非何杰金氏淋巴瘤 (NHL) | 適用於治療成人復發或難治型的B細胞非何杰金氏淋巴瘤 |
| 濾泡型淋巴瘤 | 適用於治療成人復發或難治型的濾泡型淋巴瘤 | |||
| Brexucabtagene autoleucel | Tecartus | CD19 | 被套細胞淋巴瘤(MCL) | 適用於治療成人復發或難治型的被套細胞淋巴瘤 |
| B細胞急性淋巴性白血病 (ALL) | 適用於治療成人復發或難治型的B細胞急性淋巴性白血病 (ALL) | |||
| Lisocabtagene maraleucel | Breyanzi | CD19 | B細胞非何杰金氏淋巴瘤 (NHL) | 適用於治療成人復發或難治型B細胞非何杰金氏淋巴瘤 |
| Idecabtagene Vicleucel | Abecma | BCMA | 多發性骨髓瘤 | 適用於治療成人復發或難治型多發性骨髓瘤 |
| Ciltacabtagene autolecuel | Carvykti | BCMA | 多發性骨髓瘤 | 適用於治療成人復發或難治型多發性骨髓瘤 |
編審人員:臺大醫院腫瘤醫學部主任 葉坤輝教授
資料來源:
“CAR T Cells: Engineering Patients’ Immune Cells to Treat Their Cancers was originally published by the National Cancer Institute.”更新日期:2022/05/12
CAR-T細胞療法:一種 "活體藥物"
紐約Memorial Sloan Kettering癌症中心(MSKCC)的Renier J. Brentjens博士解釋說,CAR-T細胞相當於 "為病人一種活體藥物",Brentjens是CAR-T細胞領域的另一位早期先驅領導者。
顧名思義,T細胞幫忙協調免疫反應並直接殺死被病原體感染的細胞,是CAR-T細胞療法的骨幹。
目前可用的CAR-T細胞療法是依每個病人量身訂做,它們是從病人身上取得T細胞,再經由實驗室中對其進行改造,使其表面產生蛋白質稱為「嵌合抗原接受體」,或稱CARs,CARs能識別並與癌細胞表面的特定蛋白質或抗原結合。
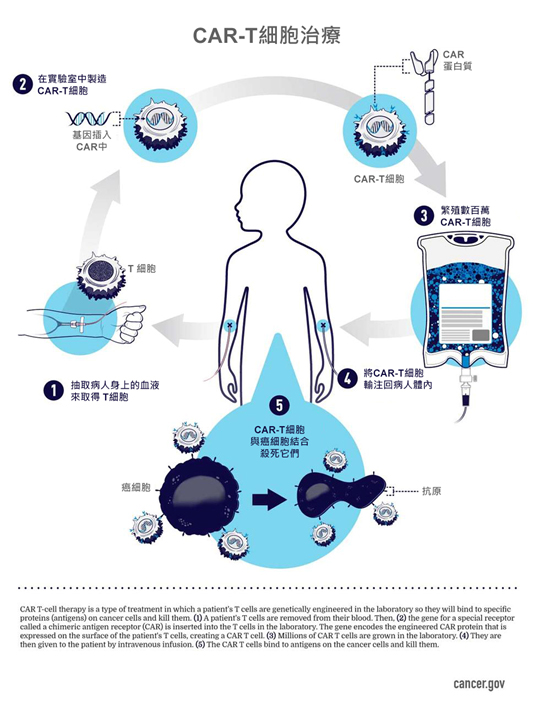
賓州大學艾布拉姆生癌症中心的醫學博士Carl June說,這些接受體是 "合成分子,它們不是天然的",Carl June博士也是CAR-T細胞治療領域的另一位先驅領導者。
改良後的T細胞在實驗室中被 "擴增"到數百萬個,然後再回輸到病人體內。如果一切依照計劃進行,CAR-T細胞將繼續在病人體內繁殖,並在其工程受體指導下,識別並殺死任何在其表面帶有標靶抗原的癌細胞。
到今天為止,美國FDA核准了針對B細胞上的兩種抗原之一,即CD19或BCMA的CAR-T細胞療法。
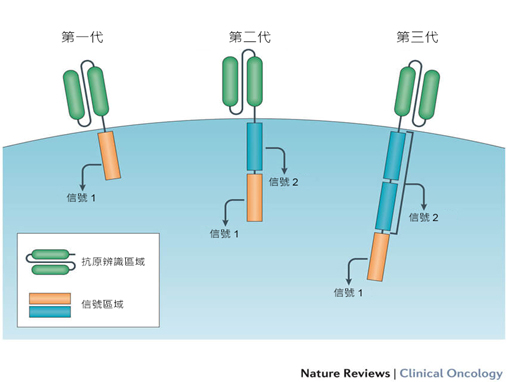
CAR-T細胞的製備
越來越多的CAR-T細胞療法正在臨床研究中進行開發和測試,儘管這些療法之間存在重要差異,而這些差異會影響它們在病人身上的作用,但它們都具有類似的組成部分。每種CAR會橋接到細胞膜,受體的一部分位於細胞外,一部分位於細胞內。從細胞表面延伸出來CAR的部分,通常是由實驗室製造的抗體片段,或某區域組成。使用的區域會影響受體識別或結合腫瘤細胞上的抗原程度。每個CAR的內部具有信號傳導和 "共刺激 "的區域。在受體與抗原相互作用後,它們傳遞信號進入細胞內,使用不同的信號區域可能會影響細胞的整體功能。
編審人員:臺大醫院腫瘤醫學部主任 葉坤輝教授
資料來源:
“CAR T Cells: Engineering Patients’ Immune Cells to Treat Their Cancers was originally published by the National Cancer Institute.”更新日期:2022/05/12
新治療選擇:當可用選項極少時
CAR-T細胞療法的最初發展是集中在兒童最常見的癌症,「急性B細胞淋巴球白血病」(ALL,B淋巴細胞)。
超過80%被診斷出罹患B細胞引起的急性淋巴性白血病(ALL)孩童(它是兒童急性淋巴性白血病(ALL)的主要類型),可以透過強化化療治癒。但對於化療或幹細胞移植後癌症再回來或復發的病人來說,有效的治療方法是很有限的。
然而,在2017年,一個新的選擇出現了,美國食品藥物管理署核准了tisagenlecleucel(Kymriah)藥物,這是第一個被FDA核准的CAR-T細胞療法,它是經由臨床試驗證明可以根除復發的兒童「急性淋巴球白血病」(ALL)。
CAR-T細胞療法已經在某些病例中,研究了很長的一段時間,在兒童的長期效應也已經開始出現結果。
例如,由NCI主導的研究小組最近發表了在復發的兒童急性淋巴性白血病(ALL)的長期追蹤報告,這些兒童在臨床試驗中接受了CAR-T細胞治療。他們發現,超過一半的兒童繼續接受可能治癒的幹細胞移植,其中約60%的兒童在5年後仍活著,且他們的癌症沒有復發。
Terry Fry博士說,他在NCI以及科羅拉多兒童醫院領導的幾項 CAR-T 細胞療法的臨床試驗,在兒童急性淋巴性白血病(ALL)中使用 CAR-T 細胞療法取得的進展“非常了不起”。Fry博士還說,隨著CAR-T細胞療法的廣泛使用,它已迅速成為兒童復發性急性淋巴性白血病(ALL)的標準治療選項之一。
CD19指向CAR-T細胞也為罹患晚期侵襲性淋巴瘤的成人和兒童帶來了希望。NCI癌症研究中心的James Kochenderfer博士說,開發CAR-T細胞之前,許多這些病人是 "幾乎無法治癒",Kochenderfer博士也領導了幾項「彌漫性大B細胞淋巴瘤」病人的CAR-T細胞療法臨床試驗。
迄今為止,淋巴瘤的治療結果取得 "了不起的成功",Kochenderfer博士說,"而且CAR-T細胞已經成為幾種類型淋巴瘤的常用療法。
編審人員:臺大醫院腫瘤醫學部主任 葉坤輝教授
資料來源:
“CAR T Cells: Engineering Patients’ Immune Cells to Treat Their Cancers was originally published by the National Cancer Institute.”更新日期:2022/05/12
認識和處理CAR-T細胞療法的副作用
像所有的癌症治療一樣,CAR-T細胞療法可能引起嚴重的副作用,包括產生抗體的B細胞大量死亡和感染。最常見和最嚴重的副作用之一是「細胞激素釋放症候群」(CRS)。
作為其免疫相關職責的一部分,T細胞釋放激素與化學信號,有助於刺激和調控免疫反應。就細胞激素釋放症候群(CRS)而言,輸注的T細胞在血液中充斥著細胞激素,因而造成嚴重的副作用,包括危險的高燒和血壓急劇下降。在某些情況下,嚴重的CRS可能會致命。
諷刺的是,細胞激素釋放症候群(CRS)被認為是CAR-T細胞療法的 "標靶"效應,也就是說,它的存在顯示T細胞在體內發揮作用。Kochenderfer博士解釋說,一般來說,體內癌細胞數量非常多的病人更有可能遭受到CAR-T細胞帶來的嚴重CRS反應。
在許多兒童和成人病人中,可以使用包括固醇藥物的標準支持性療法來治療輕微的細胞激素釋放症候群(CRS)。而隨著研究人員在CAR-T細胞治療方面得到的更多經驗,他們已發現好好地妥善處理嚴重CRS病例的方法。
大部分處置CRS是Tocilizumab(Actemra)藥物,這種藥物最初是用於治療青少年關節炎等炎症性疾病,它阻斷IL-6的活性,IL-6是由T細胞和巨噬細胞對發炎反應所分泌出的細胞激素。
CAR-T細胞療法另一個需要特別留意的副作用是對神經系統的影響,包括嚴重的意志混亂、類似癲癇的動作和說話障礙。這些神經系統副作用(也稱為「免疫效應細胞相關的神經毒性症候群」,或ICANS),它的確切產生原因仍不清楚。
儘管它對治療「細胞激素釋放症候群」(CRS)很有效,但tocilizumab似乎對ICANS沒有幫助。Jennifer Brudno博士解釋說,「類固醇」是目前治療嚴重ICANS的最佳選擇,特別是dexamethasone,它比其他類固醇更能進入中樞神經系統。Jennifer Brudno博士是參與了NCI癌症研究中心的多個CAR-T細胞療法的臨床試驗。
Brudno博士說,目前正在深入研究預防CRS和ICANS的不同方法,其中一種方法是預防性使用tocilizumab和低劑量的類固醇。Brudno博士說雖然還需要進一步研究,但 "目前為止得到的數據是令人安心的"。
其他針對ICANS的治療方法也在進行中,例如,在一些很小型的研究中發現,用於治療類風濕性關節炎的Anakinra(Kineret)的藥物,可能有助於預防CAR-T細胞療法的病人出現嚴重的ICANS。
Brudno博士解釋說,防止嚴重CRS和ICANS的另一個想法是修改CARs本身。
例如,在一項針對成人淋巴瘤病人的小型臨床試驗中,使用NCI開發的 "重塑 "CD-19指向CAR-T細胞治療的病人,其嚴重的神經系統副作用遠遠低於過去史上使用同CAR的「原始型」少得許多。
編審人員:臺大醫院腫瘤醫學部主任 葉坤輝教授
資料來源:
“CAR T Cells: Engineering Patients’ Immune Cells to Treat Their Cancers was originally published by the National Cancer Institute.”更新日期:2022/05/12
更多用於實體腫瘤的標靶抗原
對CAR-T細胞的研究正在迅速進行,其中包括了數百項正在進行的臨床試驗。這種擴增的部分原因是研究人員在腫瘤細胞上發現其他抗原,它們是指向CAR-T細胞很好的抗原。
雖然美國FDA目前為止只有批准CD19和BCMA是的CAR-T細胞療法的抗原,但CAR-T細胞療法已經開發出針對血液癌中常見的其他抗原,包括一次指向多種抗原的療法。
但使用CAR-T細胞治療實體腫瘤,如腦癌、乳癌或腎臟癌效果如何呢?這些癌症,過去是CAR-T一直很難有進展的。Rosenberg博士說,在實體腫瘤表面鑑定抗原而非健康細胞表面上的努力,"很大的程度是不成功的"。
實體腫瘤另一個障礙是它們的周圍環境,例如,物理性障礙阻止輸注CAR-T細胞到達腫瘤細胞。微環境的其他部分,如腫瘤細胞或其他免疫細胞產生的免疫抑制分子,可能導致CAR-T細胞沒有發生作用,使它們無法執行其細胞殺傷任務。
史丹福大學派克癌症免疫治療研究所主任Crystal Mackall, M. D.,說,也許最大的障礙是 "一個由來已久的問題:腫瘤的特異性"。
換句話說,相同癌症類型的實體腫瘤其分子可能因病人而異,甚至在特定病人中也是如此。例如,一些腫瘤細胞上可能「沒有」可指向的特異腫瘤抗原,或者可能有,但沒有足夠的抗原使CAR-T細胞發揮其應有的功能。
儘管有這些障礙,研究人員仍繼續設法找出使用CAR-T細胞治療實體腫瘤的方法。
其中一種方法是試圖勝過許多晚期實體腫瘤的免疫抑制環境,例如,一些研究小組已經開發了所謂的 "裝甲車" CAR-T細胞,它們可以藉由分泌特定的細胞激素和其他分子在通過這種困難的微環境。
其他研究人員正在尋求更一般的方法,就是倚賴標準CAR工程技術,與指向癌細胞的單一表面抗原。
例如,在實驗室和動物研究上取得滿意的結果之後,史丹佛大學Mackall博士的小組啟動了一項由NCI支持的CAR-T細胞療法的臨床試驗,該療法針對實體腫瘤上一種名為B7-H3的蛋白質。在另一個試驗中,她的小組正在研究一種CAR-T細胞療法,該療法針對的是癌細胞上一種叫做GD2的分子,該分子存在在一些罹患相同致命的「腦癌」(稱為DIPG)的兒童和年輕成年人中。
Mackeall博士在2021年腫瘤免疫治療學會年會上解釋說,對於GD2 CAR-T細胞試驗,最初它的預想方式和之後的執行方式是完全不同。
最初,病人僅接受初始的靜脈輸注CAR-T細胞治療,但是,類似CAR-T細胞療法的動物研究使得研究人員改變了試驗:對初始靜脈輸注有反應的病人,再額外給予較小劑量直接輸注到腦部。
Mackeall博士在報告中指出,給予病人多劑量藥物導致腫瘤反應(例如,縮小腫瘤大小)和他們癌症的相關症狀改善了。
研究團隊還快速修改試驗中使用的GD2 CAR-T細胞及其製造方式,以提高其潛在的療效和安全性。Mackeall博士說,能夠做出如此迅速的改變,凸顯了細胞療法持續創新的關鍵重要性。
她說“我想所有在這個領域都知道我們對於基因修改這些CAR-T cells的了解,都只是冰山一角”。還有很多新世代的方法,是為了解決固態腫瘤治療效果不佳的問題
編審人員:臺大醫院腫瘤醫學部主任 葉坤輝教授
資料來源:
“CAR T Cells: Engineering Patients’ Immune Cells to Treat Their Cancers was originally published by the National Cancer Institute.”更新日期:2022/05/12
「現成的」CAR-T細胞療法: CRISPR、自然殺手(NK)和mRNA
研究人員也已經開始重新考慮CAR-T細胞療法的免疫細胞來源--使用不是從病人身上收集的T細胞,而是從「健康捐贈者」身上收集T細胞。目標是:"現成的 "CAR-T細胞療法,可以立刻使用,而不必為每個病人單獨生產。
所有美國食品藥物管理署FDA核准的CAR-T細胞療法都依賴於一種卸除病毒方法,將遺傳物質輸送到T細胞中以產生CAR。但對於目前正在進行的小規模臨床試驗中測試現成的CAR-T細胞,是使用TALON和CRISPR等基因編輯技術來誘發捐贈的T細胞產生CARs。
其他現成的CARs也使用不同類型的免疫細胞,稱為「自然殺手(NK)細胞」。這方面的研究大部分仍處於早期階段,但一些CAR-NK細胞療法已經在小型臨床試驗中進行了。
不僅要重新考慮T細胞的來源和免疫細胞的類型,而且還要重新考慮實際治療的地方。例如,一些研究小組正在使用奈米技術和以mRNA的方法,讓體內產生CAR-T細胞。
資料來源:
“CAR T Cells: Engineering Patients’ Immune Cells to Treat Their Cancers was originally published by the National Cancer Institute.”更新日期:2022/05/12
不是只是癌症治療的最終努力?
在大多數情況下,直到一個人的癌症經過多種治療後,變得更惡化後才會考慮讓他接受CAR-T細胞療法,但這種情況已經開始改變。
最近,在兩個大型臨床試驗中,對於癌症在首次或第一線化療後復發的非何杰金氏淋巴瘤病人,CAR-T細胞療法已證明比標準治療更有效。
這個發現使得一些專家得出結論,對於這些病人來說,CAR-T細胞療法很快就能取代許多化療,成為標準的第二線治療。
Fry 教授說,以這種方式使用CAR-T細胞,對於一些罹患急性淋巴性白血病(ALL)的孩童來說特別有吸引力。具體來說,他指出那些在首次接受化療後疾病復發的高風險兒童,首次化療通常要進行2.5年左右。事實上,一些小型的臨床試驗已經在進行中,使用CAR-T細胞在首次化療反應不佳的ALL兒童。


